近期,南京农业大学动物科技学院刘红林教授、申明副研究员团队在猪卵泡发育的分子机制研究中取得重要进展,两篇高水平研究论文“Oocytes and hypoxanthine orchestrate the G2-M switch mechanism in ovarian granulosa cells”和“FOXO1 mediates hypoxia-induced G0/G1 arrest in ovarian somatic granulosa cells by activating the TP53INP1-p53-CDKN1A pathway”连续发表在发育生物学权威杂志《Development》。
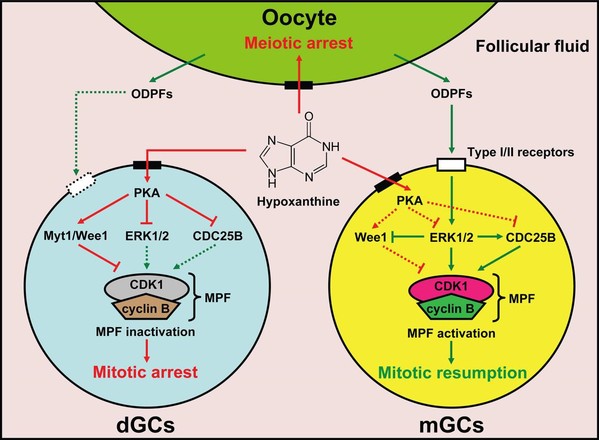
雌性动物出生后,卵母细胞一直停滞在减数第I次分裂前期的双线期。直至初情期到来后,在LH激素峰的作用下,减数分裂才能重新启动。早在上世纪80年代,美国科学院院士John Eppig教授发现卵泡液中含有抑制卵母细胞自发恢复减数分裂的小分子物质。次黄嘌呤(Hx)被证明是这些小分子抑制物中的主要活性成分,可通过抑制磷酸二酯酶的活性提高cAMP水平,抑制卵母细胞促成熟因子(MPF,即CDKl/cyclin B复合物)活性,从而维持卵母细胞减数分裂抑制。卵泡颗粒细胞与卵母细胞处于相同的卵泡环境中,颗粒细胞的增殖同样需要MPF活性,但次黄嘌呤对颗粒细胞增殖的影响却缺少报道。
本研究首次证明,生理浓度的Hx能够通过抑制MPF活性,将颗粒细胞阻断在G2期,并且这种抑制作用的解除依赖于TGF-β1的添加,而不是FSH、LH、IGF1、EGF等激素或生长因子。进一步研究揭示,在卵泡中,卵母细胞可通过分泌GDF9和BMP15这两种TGF-β超家族成员解除Hx引起的颗粒细胞有丝分裂阻滞,其机制在于:GDF9和BMP15与颗粒细胞上的GDF9/BMP15受体结合后,通过激活ERK1/2通路,抑制Wee1活性,从而抑制CDK1的Thr l4和Tyr l5位点磷酸化。ERK1/2还可激活CDC25B磷酸酶活性,进一步降低Thr l4和Tyr l5这两个位点磷酸化水平,从而增强CDK1活性,使被Hx抑制的MPF活性得以恢复,因此诱导颗粒细胞从G2进入M期,促进有丝分裂的进行。值得注意的是,GDF9/BMP15受体含量较低的颗粒细胞不仅对Hx诱导的G2期阻滞更敏感,而且更容易从卵泡壁脱落成为游离颗粒细胞(dGCs)。同时,Hx诱导的G2期阻滞会引发dGCs的凋亡。由于颗粒细胞脱落和凋亡是卵泡发生闭锁的重要特征,可以预见颗粒细胞GDF9及BMP15受体的差异表达可能是引起卵泡选择性闭锁的潜在原因。
卵泡发育是雌性生殖的基础,卵母细胞减数分裂抑制和颗粒细胞有丝分裂增殖是确保卵泡正常发育必须具备的两个基本条件。然而,在同一卵泡环境中如何实现二者的协调统一尚缺乏足够的认识。本研究为这一问题的回答提供了可能性的解释,加深了人们对卵泡发育机制的了解。另一方面,目前尚不明确卵母细胞是否参与卵泡闭锁的启动。本研究表明,Hx抑制细胞增殖后显著增加了颗粒细胞凋亡;而卵母细胞分泌因子可消除Hx对颗粒细胞有丝分裂的抑制作用,进而阻止颗粒细胞凋亡和脱落。这些发现为研究“卵母细胞是否参与卵泡闭锁的启动”指明了可能的途径:即卵母细胞分泌功能障碍导致颗粒细胞无法解除Hx引起的增殖阻滞从而启动了卵泡闭锁。
卵泡低氧微环境影响猪卵泡颗粒细胞增殖的关键机制被探明
卵巢卵泡生长发育是母猪发情排卵的生理基础。生长中的卵泡具有两种命运:继续发育与退化闭锁,卵泡命运决定机制一直是繁殖生物学领域需要解决的核心科学问题。卵泡发育依赖于颗粒细胞的活跃增殖,颗粒细胞增殖活性显然与卵泡命运相关。然而,颗粒细胞增殖活性随着卵泡发育逐渐减弱。那么,是什么原因导致卵泡发育过程中颗粒细胞增殖潜力的逐步降低?
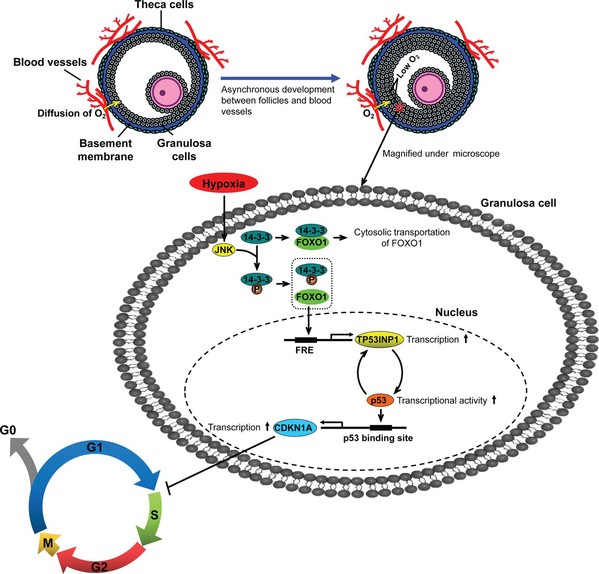
在哺乳动物卵泡中,毛细血管分布于卵泡膜层,未能突破基膜进入颗粒细胞层,导致颗粒细胞出现低氧状态。随着卵泡发育变大,颗粒细胞层与卵泡毛细血管的距离越来越远,导致颗粒细胞低氧程度不断加剧。那么低氧是否与颗粒细胞增殖状态有关?
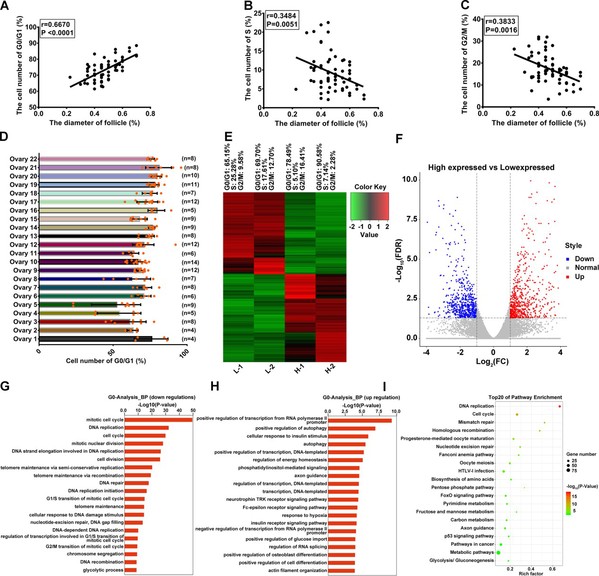
本研究采用流式细胞术检测了数百个猪有腔卵泡颗粒细胞周期,结果发现,随着卵泡直径的增加,卵泡颗粒细胞G0/G1 期比例显著升高。不仅如此,研究还发现,同样大小的猪有腔卵泡其颗粒细胞G0/G1 期比例也存在较大差异。试验剥取了近200 个直径4 mm 左右的猪卵泡,分离的颗粒细胞进行细胞周期检测,根据G0/G1 的比例,分为G0/G1 比例高组和G0/G1 比例低组,进行转录组测序分析。测序结果GO 分析发现,低氧应答是调控颗粒细胞G0/G1 阻滞的主要生物学过程。利用体外低氧模型,进一步证实低氧是诱导卵巢颗粒细胞G0/G1 阻滞,抑制颗粒细胞增殖的重要因素。
为明确低氧调控颗粒细胞周期的下游通路,课题组对转录组测序结果进行KEGG pathway 分析,发现在G0/G1 比例高组的颗粒细胞中显著富集到FOXO 信号通路。进一步研究揭示,在体内外低氧条件下,G0/G1期颗粒细胞的比例升高伴随着FOXO1核转运的增多,而敲降FOXO1后,可促进颗粒细胞从G0/G1进入S期。
根据测序结果,本研究从差异基因中找到了一个极显著上调的候选基因TP53INP1。生物信息学分析显示,TP53INP1 基因启动子区存在FOXO1 的结合位点。利用采用荧光素酶活性分析、染色质免疫共沉淀(ChIP)等技术,研究证实TP53INP1是FOXO1靶基因。同时,TP53INP1 与p53 存在复杂的相互调控,一方面TP53INP1 是p53 下游靶基因,另一方面,TP53INP1 能够激活p53 活性,表现为对p53的正反馈调控。进一步通过ChIP、RNAi等技术探索FOXO1/TP53INP1/p53轴的机制及功能,结果表明:在低氧环境中,颗粒细胞FOXO1入核直接上调了其靶基因TP53INP1表达,进而激活p53,而p53作为调控CDKN1A表达的关键转录因子上调了CDKN1A表达,最终CDKN1A发挥细胞周期抑制功能引起颗粒细胞增殖阻滞。
本研究首次从低氧角度解析卵泡颗粒细胞增殖调控机制,这将有助于明确卵泡命运决定的本质,并有可能为调控卵泡发育提供新的作用靶点,从而为提高家畜繁殖力以及人类不孕症的临床治疗提供途径。
论文一作为博士生李诚瑜,通讯作者申明副研究员、刘红林教授,刘昭君、吴刚、周佳奇、李伟建、刘烁等研究生也参与了上述研究。该研究得到了国家自然基金项目(31972564; 31972571; 31630072; 31601939)的资助。








